前言
类器官是指在生物学理论的基础上,借助组织工程技术,在体外构建的一种能够模拟体内器官复杂生物学功能的组织类似物。类器官能复制器官结构的三维结构和功能,为研究疾病机制、药物反应和组织再生提供了一个独特的方式,弥补了传统细胞培养与体内研究之间的差距。在骨和软骨缺损修复与再生等研究领域,人们一直在寻求更准确、更具代表性的模型。而骨/软骨类器官是实现这一目标的一个很有前景的途径,它提供了一个更好的平台来模拟骨/软骨内错综复杂的生物相互作用。因此,本篇将结合最新的骨/软骨类器官文献,向大家介绍骨/软骨类器官的研究现状、构建方法及未来应用前景。
什么是骨/软骨类器官?
骨/软骨类器官指以生物活性材料为基础,通过体外3D培养结合定向诱导技术,将各类干细胞(如骨骼干细胞、胚胎干细胞等)或功能细胞(如成骨细胞、破骨细胞等),培育组装成为具有自我更新、自我组织能力且具有骨空间特征的类骨组织,可用于骨骼发育和调控机制研究、药物筛选及骨组织再生修复。骨/软骨病变将会显著影响患者关节功能,如骨关节炎、椎间盘退变、剥脱性软骨炎等,延缓或逆转软骨退变是治疗骨关节炎的重要思路。然而骨关节炎药物研究周期长、投入大、风险高,迫切需要新的研究模型和工具。通过在体外构建骨/软骨类器官,模拟骨/软骨正常生理功能和骨关节炎中的病理生理改变,可用于临床新药筛选及效果评价[1],减少研究的成本和风险。
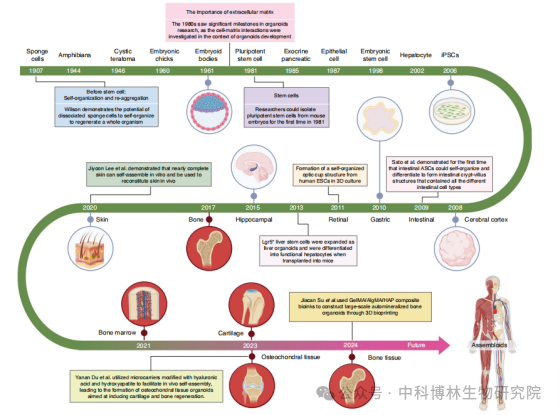
骨/软骨类器官的发展史
骨/软骨类器官的构建策略
骨和软骨类器官的构建基础主要包括选择适当的细胞、基质凝胶、细胞因子、诱导剂和构建技术,通过以上手段来有效地复制这些组织的复杂结构和功能,具体构建方法主要分为直接构建法和间接构建法。
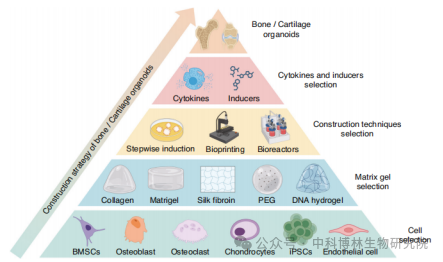
1.直接构建法
直接构建法的构建策略是指根据成年后骨塑建或骨改建的理论,通过在支架材料上接种成骨前体干细胞、成骨细胞、破骨前体细胞及软骨细胞,并诱导使细胞与材料发生自组装,形成类骨样结构。
Lordachescu等于2017年应用含磷酸钙的纤维素凝胶系统,加入成骨细胞自我组装成类骨样结构,再现了钙盐沉积及骨成熟多个阶段,得到类似天然骨的多级结构和骨细胞网络[2]。随后,该课题组选取牛股骨小梁颗粒作为系统基础,将成骨细胞和破骨细胞同时种植在股骨头微型小孔,应用破骨细胞分化因子及巨细胞集落刺激因子刺激破骨形成,进一步应用类固醇及阝-甘沺磷酸酯促进成骨细胞矿化,成功构建微米级骨类器官[3]。在构建的类器官中可观察到大的骨细胞突起和管状结构以及新基质生成,该研究可用于研究骨改建过程,揭示病理性骨质流失和骨骼重塑疾病机制。在软骨类器官方面,Abraham 等从儿童捐献者获得骨及软骨组织,酶解获得细胞后再分别进行骨及软骨类器官构建。为了更好模拟关节发育及疾病状态,该团队还将同时含有骨和软骨成分的肋骨消化获得的细胞进行骨-软骨诱导分化,最终获得含有骨和软骨组织的迷你关节球。该模型能够成功模拟关节炎症,对药物疗效进行评价[4]。
骨/软骨类器官直接构建示意图
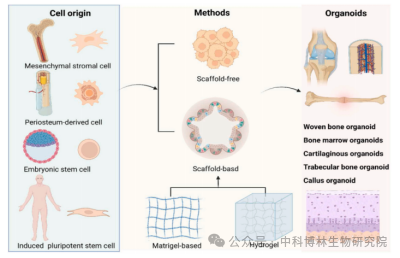
2.间接构建法
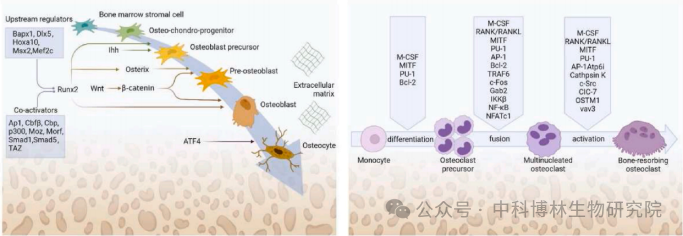
间接构建骨类器官的策略为先诱导干细胞形成软骨,软骨再发生矿化形成骨组织,即通过模拟软骨内成骨过程中的关键发育事件来促进有效骨组织再生。在软骨内成骨过程中,间充质干细胞在缺损部位聚集,分化形成“骨痂”软骨核心,随后骨痂内软骨细胞发生肥大、钙化和凋亡,成骨祖细胞发生募集并开始向成骨方向分化。
Tam 等研究了人多能干细胞的体外和体内软骨组织形成能力,发现诱导多能干细胞可定向分化为软骨细胞,随后自组装成软骨类器官。分化形成的软骨类器官能够表达与原代人关节软骨细胞相似水平的I型胶原蛋白,并在体内异位植入时产生稳定软骨。该研究在促肥大和促炎模型中,成功利用类器官桥接了免疫功能低下小鼠的临界尺寸长骨缺损[5]。
O'Connor等报道了一种通过诱导多能干细胞培养骨软骨类器官的方法,利用小鼠诱导多能干细胞(miPSC)开发了一种骨软骨类器官。将miPSC以时间依赖性连续暴露于生长因子TGFB-3和BMP2中,通过软骨内骨化反映构建效果。结果显示该方法培养获得了包括软骨区域和钙化骨区域的骨类器官,该类器官可以模拟骨关节炎特点,进行关节疾病药物筛选和遗传风险评估[6]。
Hall 等提出了一种应用人骨膜衍生细胞(hPDC)自组装构建骨痂类器官的方法。首先hPDC长期培养遵循软骨内骨化的早期模式,即hPDC自组装获得软骨微球体,随后软骨微球体发生骨化形成骨痂类器官。该类器官还可以融合为更大组织,用来治疗较大范围骨缺损[7]。由于在骨折愈合过程中形成“软骨痂”的大多数细胞都来自骨膜,因此hPDC在长骨缺损的再生中有很大的应用前景。
浙江大学欧阳宏伟等报道了体外高效构建骨痂类器官用于大段骨缺损修复的方法。研究团队通过数字光处理打印技术,实现负载有骨髓间充质干细胞(BMMSC)的水凝胶微球能够高效的使BMMSC在微球中聚集。随后在软骨诱导培养基中诱导分化3周后,构建出与人体发育过程中相似的骨痂类器官。研究人员发现,体外逐渐成熟过程中骨痂类器官的表型基因表达模式与天然骨化的软骨类似。此外,将骨痂类器官植入体内后,发现其具备高效的异位骨形成和原位骨再生能力,有助于大段骨缺损在4周内快速使原位骨再生[8]。
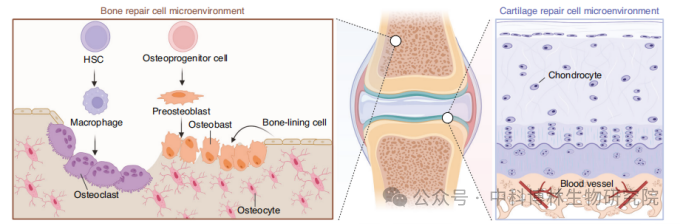
骨/软骨形成过程中的细胞微环境
然而,直接构建法和间接构建法均存在周期长、成本高、重复性差等缺陷。浙江大学贺永[9]发明了一种新型的气流辅助3D生物打印方法成功构建多细胞骨类器官。该研究以水凝胶微球体为培养载体,分别植入人骨髓间充质干细胞和人脐带静脉内皮细胞进行成骨及成血管诱导。培养10天后,可以观察到明显血管化的骨组织。与常规生物制造方法不同,该研究首次利用数学建模及机械手段,实现了细胞空间结构的可控成型,为构建骨类器官提供了新思路。

气流辅助3D生物打印示意图
骨/软骨类器官的应用
1.药物预测
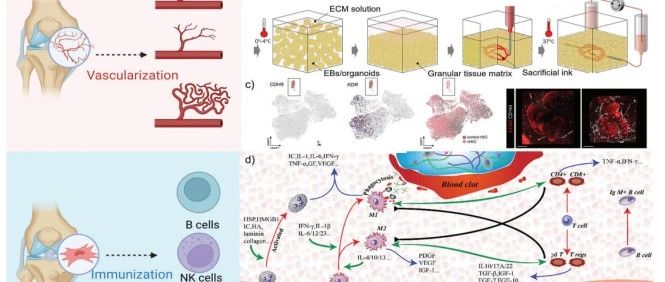
临床上绝大多数治疗骨疾病的药物在临床批准之前需要经过长期的体外和体内检测过程。常用的细胞和动物实验结果向临床转化往往并不顺利。人骨和软骨类器官的构建可大大缩短药物检测周期,为药物毒性预测提供更准确的手段。在药物研究中,特别是对于慢性骨病或缺乏大规模临床试验的情况,骨类器官可以为功能检测、表型分析等提供充足的资源,是药物毒性预测、新药筛选和个体化治疗的优良模型[10]。
2.再生修复
再生医学的主要目标是在体外用健康组织替代功能性或受损的器官,实现无免疫抑制、无疾病和毒性降低的再生修复,并避免终身抗排斥治疗的巨额费用。骨类器官可与同源基因组织扩增,用于自体移植,为器官替代治疗提供可再生资源。此外,骨相关细胞和类骨器官产生的骨生长活性因子也可作为生物活性成分,诱导骨再生过程,这些生物活性成分有望改善传统组织工程生物材料的再生和修复效果[11]。
3.疾病模型
骨和软骨类器官能够模仿骨和软骨组织的关键特征,已经成为疾病建模领域的创新和有前途的工具,其被应用于模拟多种疾病,如骨关节炎、骨折和愈合、类风湿性关节炎、遗传性骨疾病和软骨再生和修复等。这些模型有助于对疾病机制的进一步洞察,并可以应用于药物测试以及实施相应的治疗干预措施。
4.生物材料的评估
目前,骨和软骨植入生物材料的临床前评价主要是通过大量动物试验来获取数据。并且,在大规模临床试验中,由于种属差异,这些动物获得的数据往往不一致。骨类器官的构建可以实现骨植入材料的体外检测,从而替代体内评价,减少动物牺牲。另一方面,人骨类器官的构建可以更好地模拟人体内环境,避免物种差异导致的数据不匹配,实现对骨植入生物材料的准确临床前评价。
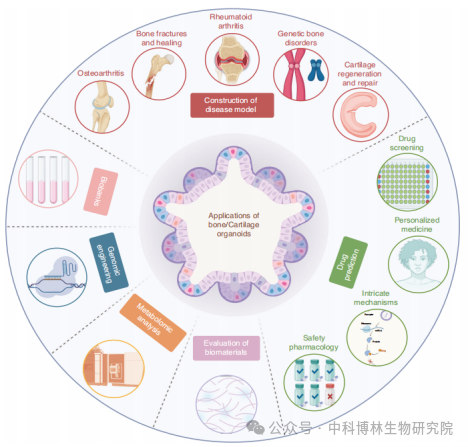
骨/软骨类器官的应用示意图
骨/软骨类器官的前景和挑战
骨类器官的研究处于初级阶段,仍面临一些挑战。首先,已报道的骨类器官仅代表骨的一种功能,如骨形成、骨吸收或造血。如何在一个完整的骨器官中实现多功能仍然是一个巨大的瓶颈。其次,另一个挑战是3D血管化[12]。众所周知,较大尺寸的组织甚至身体包含丰富的血管网以支持营养和氧气供应。可以想象,血管化将是大型骨类器官的先决条件。
受骨组织工程方法的启发,血管内皮细胞有可能被共孵育以构建血管化的类器官。此外,基因编辑工具可以帮助科学家重复丰富的骨骼疾病模型,用于药物和生物机制研究的发现,具有候选基因功能的个性化骨类器官或疾病特异性骨类器官将用于研究组织生理学和癌变的一些原始模型。最后,通过整合新兴的3D打印技术或基于细胞的自底向上制造,它能够实现仿生和层次结构的构建,包括生物矿化和时空特征[13]。总的来说,骨和软骨类器官具有巨大的潜力来模拟发育和疾病,作为药物测试的工具,以及作为再生医学的治疗方法。未来的努力无疑将使骨类器官更接近实现这一潜力。
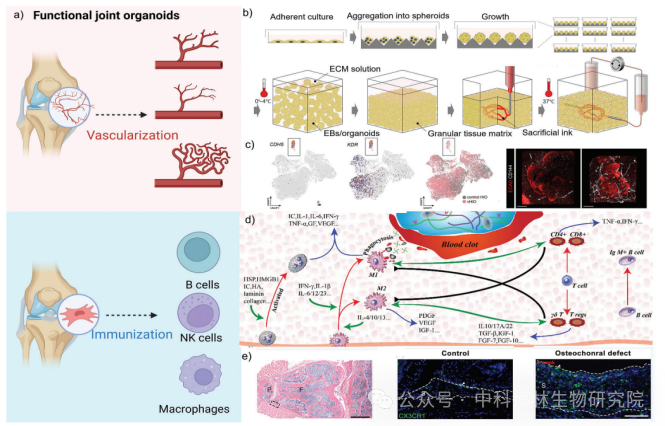
骨/软骨类器官的前景和挑战示意图
参考文献
[1]Chen S, Chen X, Geng Z, Su J. The horizon of bone organoid: A perspective on construction and application. Bioact Mater. 2022 Feb 5;18:15-25. doi: 10.1016/j.bioactmat.2022.01.048.
[2]陈晓,苏佳灿.骨缺损治疗新技术:骨类器官.中华创伤杂志,2022,38(4):293-296.
[3]Iordachescu A, Hughes EAB, Joseph S, Hill EJ, Grover LM, Metcalfe AD. Trabecular bone organoids: a micron-scale 'humanised' prototype designed to study the effects of microgravity and degeneration. NPJ Microgravity. 2021 May 21;7(1):17. doi: 10.1038/s41526-021-00146-8.
[4]Abraham DM, Herman C, Witek L, Cronstein BN, Flores RL, Coelho PG. Self-assembling human skeletal organoids for disease modeling and drug testing. J Biomed Mater Res B Appl Biomater. 2022 Apr;110(4):871-884. doi: 10.1002/jbm.b.34968. Epub 2021 Nov 27.
[5]Tam WL, Freitas Mendes L, Chen X, Lesage R, Van Hoven I, Leysen E, Kerckhofs G, Bosmans K, Chai YC, Yamashita A, Tsumaki N, Geris L, Roberts SJ, Luyten FP. Human pluripotent stem cell-derived cartilaginous organoids promote scaffold-free healing of critical size long bone defects. Stem Cell Res Ther. 2021 Sep 25;12(1):513. doi: 10.1186/s13287-021-02580-7.
[6]O'Connor SK, Katz DB, Oswald SJ, Groneck L, Guilak F. Formation of Osteochondral Organoids from Murine Induced Pluripotent Stem Cells. Tissue Eng Part A. 2021 Aug;27(15-16):1099-1109. doi: 10.1089/ten.TEA.2020.0273. Epub 2020 Dec 22.
[7]Nilsson Hall G, Mendes LF, Gklava C, Geris L, Luyten FP, Papantoniou I. Developmentally Engineered Callus Organoid Bioassemblies Exhibit Predictive In Vivo Long Bone Healing. Adv Sci (Weinh). 2019 Dec 10;7(2):1902295. doi: 10.1002/advs.201902295.
[8]Xie C, Liang R, Ye J, Peng Z, Sun H, Zhu Q, Shen X, Hong Y, Wu H, Sun W, Yao X, Li J, Zhang S, Zhang X, Ouyang H. High-efficient engineering of osteo-callus organoids for rapid bone regeneration within one month. Biomaterials. 2022 Sep;288:121741. doi: 10.1016/j.biomaterials.2022.121741. Epub 2022 Aug 19.
[9]Zhao H, Chen Y, Shao L, Xie M, Nie J, Qiu J, Zhao P, Ramezani H, Fu J, Ouyang H, He Y. Airflow-Assisted 3D Bioprinting of Human Heterogeneous Microspheroidal Organoids with Microfluidic Nozzle. Small. 2018 Sep;14(39):e1802630. doi: 10.1002/smll.201802630.
[10]Faeed M, Ghiasvand M, Fareghzadeh B, Taghiyar L. Osteochondral organoids: current advances, applications, and upcoming challenges. Stem Cell Res Ther. 2024 Jun 21;15(1):183. doi: 10.1186/s13287-024-03790-5.
[11]Bai L, Zhou D, Li G, Liu J, Chen X, Su J. Engineering bone/cartilage organoids: strategy, progress, and application. Bone Res. 2024 Nov 20;12(1):66. doi: 10.1038/s41413-024-00376-y.
[12]Zhang Y, Li G, Wang J, Zhou F, Ren X, Su J. Small Joint Organoids 3D Bioprinting: Construction Strategy and Application. Small. 2024 Feb;20(8):e2302506. doi: 10.1002/smll.202302506. Epub 2023 Oct 9.
[13]Wang J, Wu Y, Li G, Zhou F, Wu X, Wang M, Liu X, Tang H, Bai L, Geng Z, Song P, Shi Z, Ren X, Su J. Engineering Large-Scale Self-Mineralizing Bone Organoids with Bone Matrix-Inspired Hydroxyapatite Hybrid Bioinks. Adv Mater. 2024 Jul;36(30):e2309875. doi: 10.1002/adma.202309875. Epub 2024 Apr 30.